Gases: Relaciones de temperatura, presión y volumen
La relación presión-volumen (Ley de Boyle) y la relación temperatura-volumen (Ley de Charles y de Gay-Lussac).
La relación presión-volumen y temperatura-volumen son consecuencia de muchos experimentos a los que fueron sometidos los gases por parte de científicos hace cientos de años y cuyos resultados fueron postulados que se transformaron en las leyes de los gases y significaron un gran avance científico cuyas aplicaciones tuvieron y siguen teniendo un importante papel en el desarrollo de la teoría atómica de la materia y en la teoría cinética molecular de los gases. A continuación veremos cuáles son las dos principales relaciones que existen en este ámbito.
Relación presión-volumen: ley de Boyle
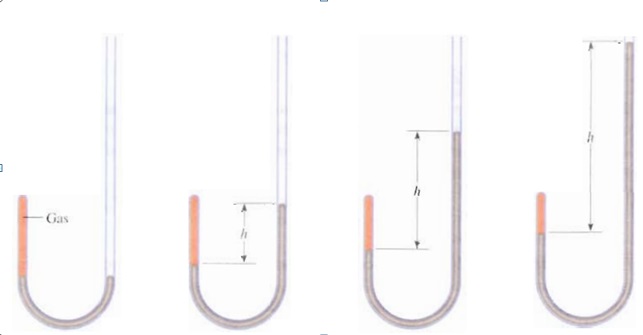
Robert Boyle durante el siglo XVII realizó una serie de experimentos sobre el comportamiento de los gases con el fin de establecer una relación entre la presión y el volumen de una muestra de gas dada. Boyle usó un instrumento como el de la figura para su experimento, se ayudó de mercurio, muy usado en esa época para los experimentos con presión. El experimento consistía en analizar el volumen del gas a distintas cantidades de mercurio.
Boyle se dio cuenta que a medida que aumentaba la cantidad de presión, la que ejerce el mercurio sobre el gas, éste disminuía su volumen. A mayor mercurio este ejerce mayor presión sobre el gas el cual disminuye su volumen. Es importante mencionar que durante sus experimentos Boyle mantuvo la temperatura constante, es decir, saco una variable de la ecuación. El gas estaba siendo sometido a la presión atmosférica (a la cual estamos todos siempre sometidos) más la presión ejercida por el mercurio. Al ordenar los datos Boyle llego a la conclusión de que existía una relación inversamente proporcional entre la presión (P) y el Volumen de un gas (V), es decir, a medida que aumento la presión en un sistema a temperatura constante, el volumen de un gas va a disminuir en la misma proporción.
Matemáticamente se representa:
El símbolo significa proporcional a
La relación temperatura-volumen: ley de Charles y de Gay-Lussac
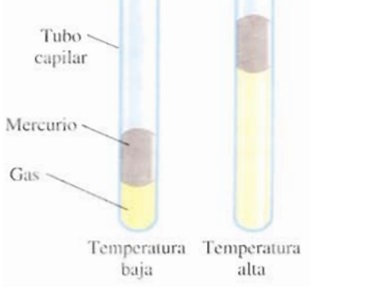
Los primeros en preguntarse cuál era la relación entre la temperatura de un gas y su volumen ocupado fueron los científicos franceses Jacques Charles y Joseph Gay-Lussac. Sus estudios demostraron que, a presión constante, un volumen dado de gas se expande cuando es calentado y se contrae cuando es enfriado:
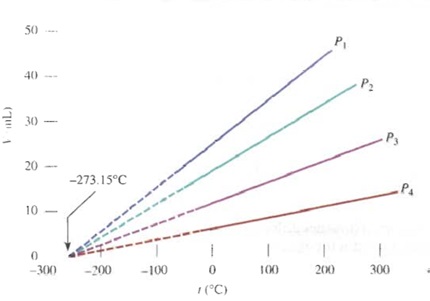
Esta relación es directamente proporcional y si lo aplicamos en un gráfico volumen vs. Temperatura este comportamiento describiría una línea recta:
Un científico llamado Lord Kelvin extrapolo esta recta hasta el volumen 0 llegando a la intersección del eje temperatura con un valor de -273,15 grados Celcius. Este científico llamo esa temperatura obtenida teóricamente como el 0 absoluto y actualmente en honor a este científico se creó la escala Kelvin donde el 0 absoluto es el 0 Kelvin.
La dependencia de un volumen (V) por su temperatura (T) se da por:
Lo que significa que existe una dependencia directamente proporcional, si aumento la temperatura de un determinado volumen de gas a presión constante este volumen aumentara proporcionalmente.